Gasvergleich - günstige Gaspreise finden Sie bei uns!
Seit dem 01. Oktober 2006 ist es Privatkunden in Deutschland erstmals möglich gewesen, sich mit einem Gasvergleich den eigenen Gasanbieter selbst auszusuchen. Auch wenn die Liberalisierung anfangs eher schleppend verlief, haben Sie als Kunde deutschlandweit mittlerweile die Wahl aus über 1.000 Energieversorger, wobei Sie je nach Region durchschnittlich jeweils aus knapp 80-90 verschiedenen Gasanbietern mit entsprechend zahlreichen Gastarifen auswählen können. Natürlich ist es dabei gar nicht so einfach, den Überblick über die günstigsten Gaspreise zu behalten.
Unser Gasanbieter Vergleich stellt Ihnen dabei eine gute Übersicht aus seriösen Tarifen zur Verfügung. Sie können den Gasvergleich jederzeit online durchführen und haben die Möglichkeit, dabei bis zu 750 Euro im Jahr einsparen zu können. Sollten Sie nicht ins Internet können, besteht auch die Möglichkeit, den Gasanbieterwechsel per Telefon durchzuführen. Sie können dann im Anschluss auch unseren Wechselservice den "Autopiloten" aktivieren. Dieser nimmt Ihnen dann den Wechsel in den Folgejahren ab. Wir kümmern uns dann um Ihren Altvertrag und wechseln jedes Jahr für sie vollautomatisch zu einem neuen Versorger. Nutzen Sie unser Vergleichsportal unkompliziert und ohne verkaufte Werbeplätze.
Sicherheit für Ihren Gaswechsel
| Sichere Gasanbieter | Sichere Gastarife | Wechselschutz |
| geprüfte Lieferanten | Keine Vorkassetarife | in 5 Minuten online wechseln |
| Kundenbewertungen | Keine Pakettarife | Garantierte Gasversorgung |
Wie funktioniert unser Gasvergleich - ein Überblick
Unser Gasvergleich funktioniert sehr einfach. Sie als Interessent müssen lediglich Ihren geschätzten Gasverbrauch (Richtwert auch über die Wohnfläche auswählbar) sowie Ihre Postleitzahl (PLZ) eingeben und schon präsentiert Ihnen unser Gasvergleichsrechner die nach dem Endpreis sortierten Gastarife, dies können Sie z.B. auch umstellen auf den Arbeitspreis. Darüber hinaus können Sie Gastarife durch bestimmte Filtereinstellungen noch individueller an Ihre Bedürfnisse anpassen.
Folgende Filter stehen im Gaspreisvergleich zur Verfügung:
Ohne Pakettarife: Tarife mit Paketpreisen beinhalten einen bestimmten Verbrauch, den Sie auf jeden Fall bezahlen. Oftmals wird dieser deutlich günstiger angeboten als bei einer verbrauchsgenauen Abrechnung. Jede Kilowattstunde, die über den Gasverbrauch im Paket hinausgeht, rechnet der Gasversorger jedoch nicht selten zu deutlich teureren Gaspreisen ab. Sollten Sie also Ihren Verbrauch ziemlich genau kennen, können Pakettarife durchaus lohnend sein. Schätzen Sie hingegen Ihren Verbrauch eher grob oder Sie haben nur die Wohnfläche als Grundlage, sind Tarife mit Paketpreisen eher nicht zu empfehlen.
Ohne Neukundenbonus: Tarife ohne Bonus in unserem Gasvergleich enthalten keine einmalige Zahlung. Ein solcher Bonus kann den gewählten Gastarif gerade im ersten Jahr sehr günstig gestalten. Im zweiten Jahr fällt diese einmalige Zahlung jedoch weg und es gilt der gewählte Tarif des Gasanbieters.
Nur CO2-neutrale/Biogastarife: Bei dieser Einstellung zeigt unser Rechner nur Tarife an, die CO-neutral sind oder mit Ökogas / Biogas arbeiten. Diese Auswahl kann die Anzahl je nach Region stärker einschränken.
Stiftung Warentest: Wenn Sie diese Einstellung im Gasanbieter Vergleich wählen, werden nur die Tarife angezeigt, die die Voraussetzungen der Empfehlungen der Stiftung Warentest enthalten und am Verbraucherfreundlichsten sind. Dazu gehören:
- Maximal 12 Monate Laufzeit
- Preisgarantie über die gesamte Vertragslaufzeit hinweg
- Keine Paketpreise
- Keine Vorauskasse
Alle Tarife anzeigen: Bei dieser Option werden wirklich alle Gastarife im Gasvergleich angezeigt, die die Gasversorger in Ihrer Region zur Verfügung stellen. Unter Umständen finden Sie hier besonders günstige Angebote, bei denen jedoch nicht ausgeschlossen ist, dass Tarifmerkmale wie Vorauskasse oder fehlende Preisgarantien durchaus möglich sind. Wenn Sie sich bei dieser Einstellung unsicher sind, können Sie natürlich auch unsere kostenfreie Hotline unter 0351 41 898 235 kontaktieren.
Ohne Onlinetarife: Onlinetarife beinhalten lediglich eine Online-Kundenbetreuung. Wenn Sie also einen Gastarif nutzen möchten, der Ihnen eine telefonische Kundenbetreuung bietet, können Sie die Onlinetarife mit dieser Einstellung in unserem Gasvergleich herausfiltern.
Wir haben in der Standardeinstellung unseres Gasvergleichs bereits einige Vorsortierungen vorgenommen und alle Tarife herausgefiltert, die längere Laufzeiten als 12 Monate beinhalten und die keine Preisgarantie über die gesamte Laufzeit hinweg bieten. Mit dieser Standardeinstellung bekommen Sie also die maximale Anzahl wirklich seriöser Tarife angezeigt und können schnell die günstigsten Tarife herausfinden. Es lohnt sich im übrigen nur sehr selten, einen Kombi-Tarif mit Gas und Strom zu wählen, weil jeder Versorger andere Kernkompetenzen hat. Wer also als Erdgasanbieter super Konditionen bietet, ist im Bereich Strom nicht selten nur Mittelmaß und umgekehrt. Wenn Sie also wirklich viel Geld sparen wollen nutzen Sie unseren Wechselservice und führen sie je einen Gasvergleich und einen Stromvergleich durch.
Wichtige Punkte zu unserem Gasvergleich im Überblick:
- Sie müssen lediglich ihren Gasverbrauch und die Postleitzahl eingeben
- Binnen Sekunden erhalten Sie die günstigsten Angebote (gemessen am Endpreis) in unserem Gasvergleich
- Sie können die Gastarife der Gasversorger im Gasvergleich individuell filtern
- Die Standardeinstellung in unserem Gasvergleich zeigt bereits seriöse Tarife
- Kombi-Tarife (Gas und Strom) lohnen sich nur selten
Vorteile eines Gasvergleichs im Überblick:
- Ein günstiger Gasanbieter kann bis zu 30% Kostenersparnis mit sich bringen
- Jährlich vom Neukundenbonus und Sofortbonus profitieren
- Stetiger Überblick über die Schwankungen am Gasmarkt
Was macht einen guten Gasvergleich aus?
Wenn Sie einen Gasvergleich im Internet nutzen, zeigen viele Versorger auf den ersten Plätzen bezahlte Anzeigen. Darüber hinaus gibt es durchaus Vergleichsrechner, die von einem bestimmten Gasanbieter oder einem Zusammenschluss einiger Versorger kontrolliert werden. Wir stellen Ihnen hingegen einen unabhängigen und neutralen Gasvergleichsrechner im Gas Vergleich zur Verfügung, der die Tarife glasklar nach ihren Kosten sortiert und eine transparente Voreinstellung der Filter. Darüber hinaus ist es jedoch auch wichtig, dass der Gasvergleich die wichtigsten Informationen zu den einzelnen Angeboten bereitstellt, damit Sie sich als Gaskunde ein Bild von dem jeweiligen Lieferanten und dem Tarif machen können.
Zu den Informationen im Gasvergleich zählen:
- Nachvollziehbarer Endpreis (zu berechnen aus Grundgebühr, Arbeitspreis und Jahresverbrauch - lediglich der Bonus und die Anzahl der Abschläge müssen beachtet werden)
- Name des Gaslieferanten, Name des Tarifs
- Gaspreis (Arbeitspreis) pro KWh und Grundpreis
- Jahresendpreis
- Vertragslaufzeit
- Laufzeit der Preisgarantie
- Kündigungsfrist
- Abschlagskosten
- Zahlungsweisen (Überweisung oder Abbuchung)
- Zusätzliche Hinweise (Paketpreise mit Zuschlägen für Mehrverbrauch oder Mindestverbrauch)
- Extra ausgewiesene Bonuszahlungen
- Vertragsbedingungen
- Gasart: zb. Ökogas
Natürlich sollten zudem Voreinstellungen beim Gasanbieter Vergleich existieren, die Angebote mit Vorauskasse und ohne Preisgarantie ausschließen. Solche Angebote werden nicht selten als unseriös bezeichnet und bergen für Sie als Kunden große finanzielle Risiken. Sie können unseren Gasvergleich auch Sortieren. So haben Sie die Möglichkeit es nach dem Endpreis, nach dem Arbetispreis und nach der Abschlagszahlung zu sortieren.
Es gibt heute fast keine Anbieter mehr, welche bei einem Anbieterwechsel keine Bonitätsprüfung durch die Schufa durchführen lassen.
Woran erkenne ich gute Gastarife im Gasvergleich?
Der Markt für Gas ist auch in Deutschland mittlerweile sehr umkämpft und bringt die einzelnen Gasanbieter dazu, Neukunden mit allerlei interessanten Tarifoptionen zu locken. Leider sind dabei nicht alle Angebote seriös. Sie können gute Tarifwerke an folgenden Eigenschaften im Gas Vergleich erkennen:
- Die Preisgarantie erstreckt sich über die gesamte Laufzeit
- Die Laufzeit übersteigt nicht den Zeitraum von 12 Monaten
- Die Kündigungsfrist liegt maximal bei 6 Wochen
- Die Bezahlung erfolgt in monatlichen Abschlägen und nicht per Vorauskasse für das gesamte Jahr
All diese Punkte sind in den Standardeinstellungen unseres Gasanbieter Vergleichs bereits berücksichtigt und machen Ihnen die Suche nach attraktiven Tarifen einfach. Der Rechner sortiert die einzelnen Angebote nach dem Endpreis und sorgt somit dafür, dass Sie stets ein großes Sparpotenzial nutzen können.
Was brauche ich für den Wechsel meines Gasanbieters?
Wenn Sie in unserem Gasvergleich einen ansprechenden Tarif gefunden haben, können Sie den Wechsel auf zwei verschiedenen Wegen vollziehen:
- Sie führen den Wechsel Telefonisch unter 0351 41 898 235 durch.
- Sie nutzen gleich unseren Gasvergleich für einen schnellen Online-Wechsel!
Neben der Eingabe Ihrer Postleitzahl und dem Jahresverbrauch (finden Sie auf Ihrer Jahresabrechnung) ist es wichtig, dass Sie Ihre Adresse, Ihre Bankverbindung und Ihre Zählernummer angeben. Der Zählerstand ist hingegen nicht wichtig, weil dieser erst beim tatsächlichen Wechsel abgelesen wird. Den Wechsel selbst übernimmt der neue Gasanbieter oder der Leitungsinhaber, so dass Sie sich nicht um die Formalitäten kümmern müssen. Als Wechselfrist sollten Sie in jedem Fall einen Zeitraum von 3 Wochen einkalkulieren, da zunächst Ihr zweiwöchiges Rücktrittsrecht abgewartet werden muss und die Umstellung etwas Zeit erfordert.
Die wichtigsten Schritte beim Gaswechsel im Überblick:
- Unseren Gasvergleich nutzen
- Schnellen Online-Wechsel durchführen
- Adresse, Bankdaten und Nummer des Gaszählers angeben
- Bei Kündigung des aktuellen Anbieters wird die Kundennummer oder Vertragskontonummer des Anbieters benötigt
- Der neue Gasanbieter kümmert sich um die Wechselformalitäten
- Nach 3 Wochen ist der Anbieterwechsel vollzogen
Gasvergleich beim Testsieger - Wechseln Sie jetzt!
Wenn auch Sie Ihre Gasrechnung deutlich verringern und dabei trotzdem attraktive Serviceleistungen in Anspruch nehmen möchten, sollten Sie unseren Gasvergleich nutzen. Dieser zeigt Ihnen schnell und unabhängig die günstigsten Angebote auf und hilft Ihnen somit, einen Gastarif zu finden, der voll und ganz Ihren Bedürfnissen entspricht und zudem auch im Gaspreis sehr günstig ist. Greifen Sie zu und fangen Sie noch heute an, Ihre Ersparnis zu steigern! Bitte beachten Sie, bei einer Gaspreiserhöhung haben Sie ein Sonderkündigungsrecht. Dieses müssen Sie selbst ausführen, und direkt beim Gaslieferanten kündigen.
Mit dieser Musterkündigung können Sie ihr Sonderkündigungsrecht bei einer Preiserhöhung wahrnehmen.
Was muss man beim Gasvergleich beachten?
Gasanbieterwechsel Wechselschutz
In Deutschland gehört die Belieferung mit Gas zur gesetzlichen Garantie (Grundversorgung) der Bürger. Selbst wenn Sie keinen Gasanbieter ausgewählt haben, werden Sie automatisch vom Grundversorger mit Gas versorgt. Es kann zu keinem Zeitpunkt für Sie zu einem Versorgungsengpass kommen.
Gasanbieter Vergleich: Woher kommt unser Gas eigentlich?
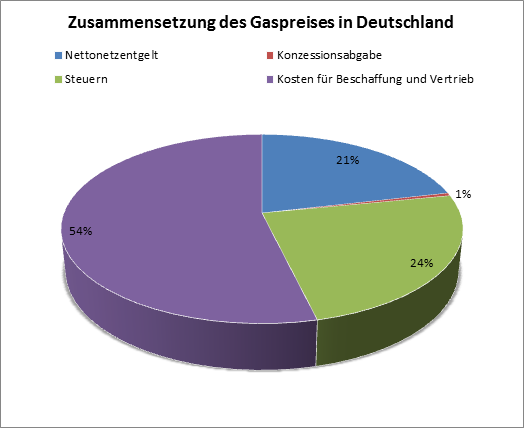
In Deutschland wird hauptsächlich Erdgas eingesetzt, welches wie Erdöl aus der Erde gefördert wird. 35% der deutschen Erdgasimporte stammen von russischen Gaslieferungen und nur ein kleiner Teil wird auch hierzulande gefördert. Dabei ist Erdgas gleich Erdgas und deshalb für die Qualität des Produktes zunächst unerheblich, von welchem Gasanbieter Sie dieses beziehen. Auch Ökogas macht im Endergebnis bei der Nutzung keinen Unterschied. Ihr Gasanbieter bezieht das an Sie gelieferte Erdgas übrigens ebenfalls vom Grundversorger und ist grundsätzlich nur für Gasabrechnung mit Ihnen zuständig. Da die Anbieter jedoch riesige Mengen vom Grundversorger abnehmen können, ergeben sich lukrativere Gaspreise, wodurch normale Gasanbieter deutlich günstiger liefern als der Grundversorger. Ökogas vom Ökogasanbieter hatte 2017 einen Anteil von 7.1% am Gasmarkt in Deutschland. Für Gas gibt es nun auch ein Gütesiegel. Das "Grünes Gas Label" Siegel. Dies ist das strengste Biogas Siegel in Deutschland.
Was wird bei einem Gasvergleich gegenübergestellt?
Unser Gaspreisvergleich stellt die Endpreise der einzelnen Angebote einander gegenüber. Dabei ist jedoch wichtig, dass die Tarife ihren Grundwerten ähnlich sind. So lassen sich beispielsweise nur Tarifwerke mit identischer Laufzeit, Kündigungsfrist, Gasart also z.B. Ökogas und Preisgarantie vergleichen, da nur so aussagekräftige Vergleichswerte entstehen. Ein Beispiel soll dies verdeutlichen:
Sie vergleichen 2 Tarife, die beide den gleichen Endpreis aufweisen. Der erste Tarif hat jedoch eine Kündigungsfrist von 6 Wochen und der zweite eine Frist von 3 Monaten. Auch wenn die Kosten hierbei gleich liegen, ist der erste Tarif interessanter, weil Sie einfacher eine Kündigung ausprechen können.
Alle Preisangeben beim Privatgas sind inklusive aller Steuern und Abgaben.
Wie kann ich Kubikmeter in Kilowattstunden umrechnen?
Der Gaszähler misst den Gasverbrauch im Kubikmeter, auf Ihrer Jahresabrechnung steht der Gasverbrauch in Kilowattstunden. Um Ihre Gaskosten zu berechnen wird aber der Wert in Kilowattstunden benötigt. Die verbrauchten kWh werden ermittelt, indem die verbrauchenten Kubikmeter mit dem Brennwert des Gases und der Zustandszahl (Z-Zahl) multipliziert werden. Diese beschreibt das Verhältnis des Gasvolumens vom Normzustand zum Betriebszustand. Formel: kWh = m3× Brennwert × Zustandszahl.
Verursacht ein Gasvergleich Kosten?
Unser Gasvergleich ist vollkommen kostenfrei nutzbar. Wir berechnen sowohl für den Gasanbieter Vergleich als auch für den Wechsel keinerlei Gebühr. In Einzelfällen kann es jedoch vorkommen, dass einzelne Gasrechner Kosten bei einem Gaswechsel mit sich bringen. Dies ist jedoch glücklicherweise leicht zu umgehen, weil es genug kostenlose Gasvergleichsportale mit Gasrechner gibt.
Warum lohnt sich ein Gasvergleich überhaupt?
Wenn Sie heute umziehen und einfach den bisherigen Tarif beim Energieversorger übernehmen, handelt es sich im Regelfall um den Grundversorger. Diese Tarife sind zwar leicht kündbar, jedoch normalerweise auch recht teuer. Nicht selten gibt es deutlich günstigere Gasversorger ( bis zu 30% Ersparnis), die trotzdem sehr faire Bedingungen in ihrem Gasvertrag bieten.
Bei einem Gasvergleich in unserem Rechner und anschliessenden Anbieterwechsels oder Neuabschluss können Sie zudem häufig von sogenannten Neukundenboni profitieren, die im ersten Jahr die Gaskosten erheblich senken. Sollten Sie nach diesem Jahr wieder wechseln, können Sie erneut vom Neukundenbonus und Sofortbonus profitieren und somit letztlich viel Geld einsparen. Als Neukunde gelten Sie immer dann, wenn Sie 6 Monate kein Kunde bei einem bestimmten Gaslieferanten waren. Somit lohnt sich der regelmäßige Gasvergleich mit Wechselantrag zwischen zwei besonders günstigenGasanbietern.

